PD-(L)1 这座宝矿还有更多等待挖掘…
当 PD-1 抑制剂还在肿瘤领域续写 「药王」 传奇时,PD-1 激动剂已悄然展现出改写自身免疫病治疗格局的潜力,有望在类风湿性关节炎、溃疡性结肠炎等自免疾病中开辟新路径。
2025 年,我们已见证 PD-1 激动剂的诸多进展:2 月 12 日,AnaptysBio 宣布其 PD-1 激动剂抗体 Rosnilimab,在治疗类风湿关节炎的 2b 期临床试验中达到主要终点及关键次要终点,且 6 个月 CDAILDA 响应率创下有史以来最高纪录;
国内方面,金赛药业的 PD-1 激动剂 GenSci120 也相继获批开展成人系统性红斑狼疮、成人原发性干燥综合征的临床试验。
目前全球范围内已有十几款在研 PD-1 激动剂类产品,尽管多数尚处于临床前阶段,但后续必然会涌现更多新进展,且入局企业或继续增多——9 月 25 日,恒瑞医药关于 PD-1 激动剂抗体的专利已公开。
2026 年,在 AnaptysBio 等领跑者的催化下,PD-1 激动剂的研发可能进入新高度。
那么,从肿瘤跨界至自免领域并逐步取得突破的背景下,PD-1 能否迎来下一个百亿美元级市场?
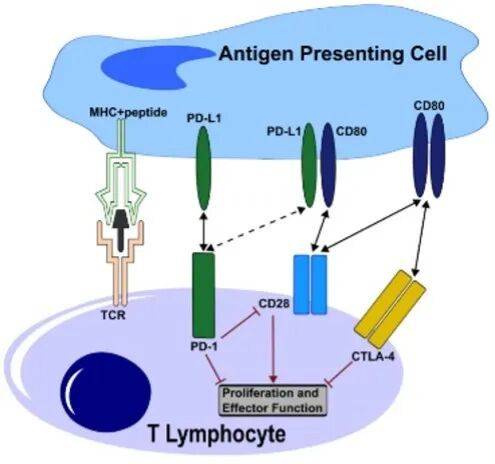
从 「刹车」 到 「油门」
PD-1 激动剂的演进,本质上是一场基于免疫机制的 「反向思维」。
在肿瘤治疗中,PD-1 抑制剂通过阻断 PD-(L)1 通路,解除肿瘤细胞对 T 细胞的免疫抑制作用,相当于给免疫系统踩下 「油门」,让 T 细胞全力杀伤癌细胞。
而在自免疾病中,病理核心是 T 细胞过度活化,攻击自身组织,此时 PD-1 激动剂的作用则完全相反。通过激活 PD-(L)1 通路,增强 「免疫刹车」 效应,抑制 T 细胞的过度反应,从而缓解炎症损伤。
这一 「双向调节」 的逻辑,源于 PD-(L)1 通路在免疫系统中的核心调控地位:它既是肿瘤免疫逃逸的关键节点,也是维持免疫稳态的平衡点。
因此,当 T 细胞表面被激动剂激活后,会抑制 T 细胞的增殖与效应功能,减少促炎细胞因子分泌,从根源上减少过度活化的 T 细胞对自身组织的攻击。
更关键的是,PD-1 激动剂的作用机制具有明确的靶向性和精准性。
在 RA 患者炎症组织中,PD-1 阳性 T 细胞比例可高达 75% 以上,正是基于这一显著的靶点富集特性,多家公司将 RA 作为首发适应症推进,而溃疡性结肠炎 (UC)也因同样机制成为了同步布局的适应症。
从更广泛的应用前景上看,PD-1 激动剂在其他 T 细胞介导的自免疾病中也具有巨大潜力:涵盖系统性红斑狼疮、干燥综合征、多发性硬化症、1 型糖尿病等多种基于 T 细胞驱动炎症的自免疾病。
其实,用 PD-1 激动剂治疗自免疾病的思路并非近年才出现。早在 2003 年,荷兰制药公司 Organnon 就启动了 PD-1 抗体的研发计划,目标是开发 PD-1 激动剂用于 RA 等自免疾病。
但受限于当时的筛选技术与机制认知不足,研发团队未能得到理想的激动剂,反而意外获得了一款 PD-1 抑制剂,这款药物后来成为全球首个上市的 PD-1 抑制剂 O 药的前身。
如今,随着免疫机制研究的深入、创新药筛选技术以及 AI 辅助抗体研发的升级,PD-1 激动剂的研发终于突破技术瓶颈,从理论走向临床验证。
PD-1 激动剂在自免领域的市场潜力,不仅源于其独特的机制优势,更得益于自免市场的 「庞大需求与未被满足的临床需求」。
2024 年全球自免药物市场规模已在 1500 亿美元左右,仅次于肿瘤药物,其中 RA、UC、SLE 等核心适应症的市场规模均超过百亿美元。
在肿瘤免疫治疗竞争白热化的当下,自免疾病领域无疑是 PD-1 激动剂的新蓝海。
曙光或已不远
当然,PD-1 激动剂的前进并非坦途。
作为最早布局 PD-1 激动剂自免领域的企业之一,礼来的 Peresolimab 曾被寄予厚望。
在 2023 年公布的 Peresolimab 治疗 RA 的 2 期临床试验结果显示:治疗 12 周后,尽管 DAS28-CRP 评分较安慰剂组明显下降。但在临床研究中,其 ACR50(较基线缓解 50% 人群比例)和 ACR70 响应方面并无显著优势。最终礼来选择将其从研发管线中剔除。
这一失败案例,让行业意识到 PD-1 激动剂研发的复杂性。
不过,PD-1 激动剂的热情,并未因礼来的失败而遇阻。
与礼来失败形成对比的是,ANAB 同期研发的 Rosnilimab 凭借独特的分子设计与临床数据,成为目前全球 PD-1 激动剂自免领域的领跑者。
Rosnilimab 药物的核心优势在于靶向性更强、耗竭致病性 T 细胞效应能力更优。它能够特异性结合 PD-1 的膜近端表位,相比其他 PD-1 激动剂 (如礼来 Peresolimab、强生 JNJ-67484703),可在外周血中消耗超过 90% 的致病性 T 细胞,而后者仅能消耗约 60%。
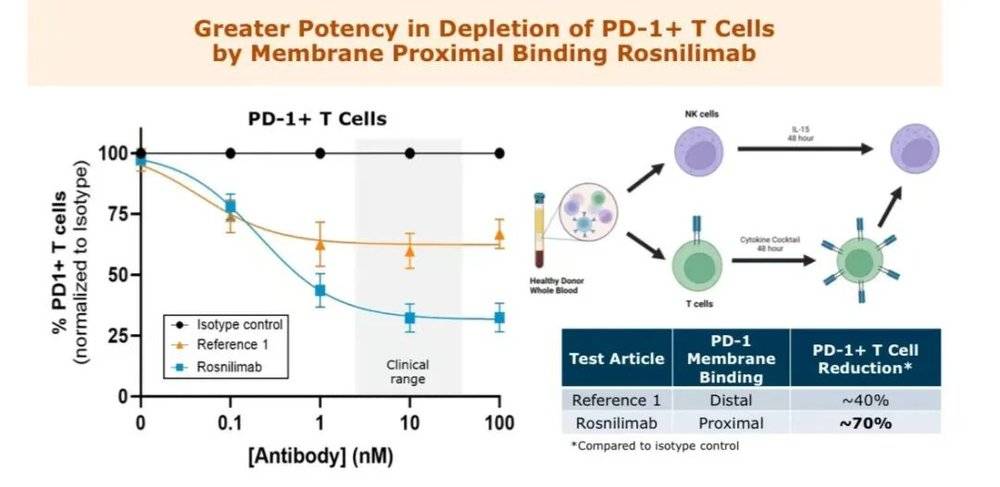
这一优势直接转化为临床疗效:在 RA 适应症的 2 期临床试验中,Rosnilimab 不仅纳入了 400 名以上的大样本患者,还在 14 周、28 周的关键时间点展现出优异的缓解效果。
在 CDAILDA(临床疾病活动指数低疾病活动度)、ACR50、ACR70 等核心指标上,其 100mgQ4W、400mgQ4W、600mgQ2W 三个剂量组的表现,均不逊色于已上市的 JAK1 抑制剂 Rinvoq 与 CTLA-4 融合蛋白 Orencia。
目前,Rosnilimab 已启动 UC 适应症的临床探索,并计划于 2026 年 Q1 读出 2 期顶线数据,若进展顺利,将成为首个覆盖 RA 与 UC 两大核心自免适应症的 PD-1 激动剂。
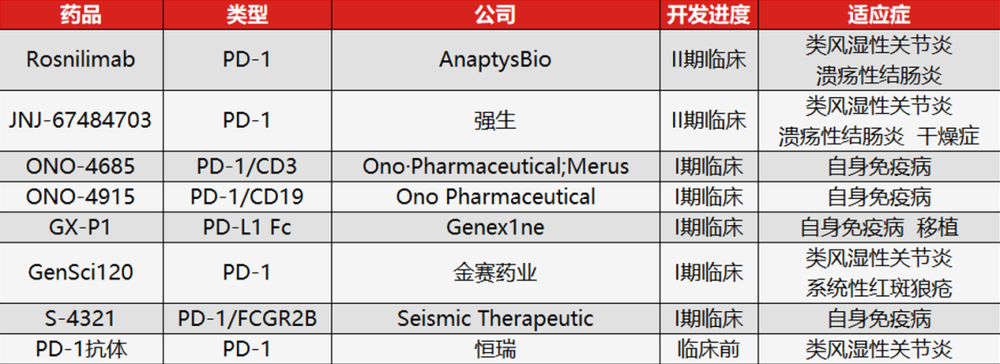
如果进展顺利,PD-1 激动剂的研发可能会在 2026 年迎来新一轮热潮。
常用常新常创新
国内药企不会缺席这场竞赛。
尽管国内企业在 PD-1 激动剂自免领域的布局晚于国外,但凭借在 PD-(L)1 领域积累的技术经验,已呈现出 「加速追赶」 的态势。
正如上文提到的金赛药业,目前已启动 PD-1 激动剂 (注射用 GenSci120)在 RA、系统性红斑狼疮 (SLE)两个适应症的 1 期临床试验,同时还计划在美国开展 RA 适应症的临床研究。
从国药监督局最新披露的信息上看,GenSci120 的临床进度比计划提前了 8 个月。
恒瑞医药也申请 PD-1 激动剂药物专利。根据公开专利信息,恒瑞医药的 PD-1 激动剂在专利中显示出较强的体外活性,部分数据优于 Peresolimab,当然仍需临床验证。
除金赛与恒瑞外,国内还有多家企业通过专利申请、合作研发等方式布局 PD-1 激动剂自免领域。
总的来说,未来谁能脱颖而出还有待验证。毕竟,如何精准控制免疫调控的程度,在保证疗效的同时规避安全风险,仍是当前 PD-1 激动剂突破自免治疗竞争壁垒的核心挑战。
但不管怎么说,从 PD-1 抑制剂到激动剂,这种同一靶点、多重应用的演变,仍是老靶点创新的经典范本。
创新未必意味着寻找新兴待临床验证的靶点,让熟悉的靶点在新的疾病适应症下焕发第二次生命同样是创新。期待 PD-1 激动剂在这场变革中,能否复制 PD-1 抑制剂的辉煌。
本文来自微信公众号:氨基观察,作者:沙晓威